특정 유전자변이 암 타깃 신약 기대감 ‘新패러다임의 시작?’
바이오스펙테이터 김성민 기자
록소 온콜로지 “LOXO-101의 환자 반응률 76%, 올해말 내년초 FDA로부터 신약허가신청”…’2nd TRK 저해제 개발’도 주목, 국내에서는 한독-CMG 제약이 공동개발 중
지난달 23일 미국 식품의약국(FDA)은 특정 유전적변이(바이오마커)에 근거한 항암신약을 승인해 큰 반향을 일으켰다. 이미 비소세포폐암 흑색종 등의 적응증으로 허가받은 MSD의 키트루다가 그 주인공으로 암의 종류가 아닌 특정 생체지표에 따라 사용 가능한 첫 항암제로 인정받았다. 바이오마커를 기반으로 항암제를 처방하는 정밀의학 시대의 시작이다.
새로운 신약허가 사례에 대한 여운이 가시지 않은 상황에서 록소 온콜로지(Loxo Oncology)가 3일 개막한 ‘미국임상종양학회(ASCO) 2017’에서 특정 유전적변이를 가진 환자군을 대상으로 한 라로트렉티닙(larotrectinib, LOXO-101)의 임상결과를 발표해 이목을 집중시키고 있다.
라로트렉티닙은 트로포미오신 수용체(TRK, tropomyosin receptor kinase) 중합형(fusion) 변이를 가진 환자에게 사용가능한 범용 항암제의 탄생 가능성을 보였다.
◇’TRK 중합’ 변이를 가진 76% 환자군에서 객관적 반응율…”늦어도 내년초 신약허가 신청서 제출”
환자에 라로트렉티닙을 투여하기 위한 바이오마커는 트로포미오신 수용체(TRK, tropomyosin receptor kinase)의 중합형(fusion)으로 임상 결과는 놀라웠다. 종양에 해당 변이를 가진 50명의 환자군에서 라로트렉티닙을 투여했을 때 76%에서 환자에서 일정시간 종양감소를 나타내는 값인 객관적반응(ORR, objective response rate)을 보이며, 1차 충족점을 만족한 것. 구체적으로 12%에서 종양이 완전 소실되는 완전반응(CR, complete response), 64%에서는 종양크기가 30% 이상 감소하는 부분적 반응(PR, partial response)을 나타냈다. 2차 중족점인 무진행 생존기간(PFS, progressive free survival)와 약물반응기간에 대한 평가는 계속적으로 진행 중이다.
한편 최초로 바이오마커를 기반으로 승인 받은 키트루다는 39.6%의 객관적 반응율을 나타냈으며, 종양에 MSI-H 또는 dMMR 유전자변이형을 나타내는 환자에 투여가능하다.
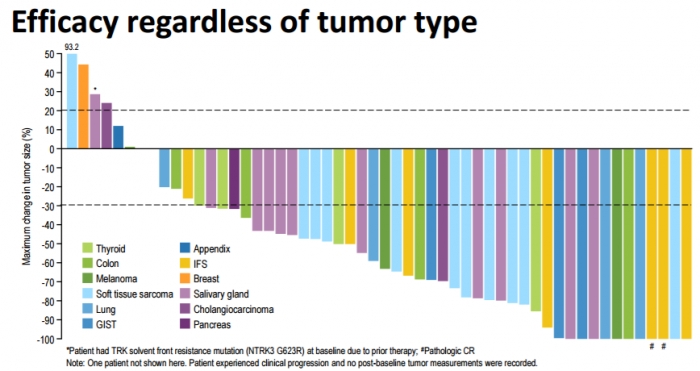
▲록소 온콜로지 발표자료 참조
